Agatha Regulatory – Système de gestion des informations réglementaires pour la recherche clinique
Application eRegulatory pour la recherche clinique
Une application de gestion réglementaire complète et centralisée pour collecter, coordonner et gérer toutes les informations et la documentation requises pour les soumissions réglementaires. Choisissez la plateforme d’Agatha pour vos documents réglementaires.

Accélérez l’approbation réglementaire avec une solution eRegulatory
L’obtention d’une autorisation réglementaire est l’étape la plus importante pour la mise sur le marché de nouveaux médicaments, dispositifs médicaux et thérapies. Le succès signifie que les patients bénéficient plus rapidement de nouvelles options, tandis que les erreurs entraînent des retards qui font perdre du temps et de l’argent. Une application de gestion de la réglementation est indispensable pour accélérer l’ensemble des activités et des processus réglementaires.
Optez pour une gestion efficace des processus réglementaires avec Agatha Regulatory
Utilisez Regulatory pour collecter, organiser et gérer les documents réglementaires avant toute soumission, afin d’assurer une source unique et officielle du contenu requis.
Solution eRegulatory pour les entreprises pharmaceutiques
Agatha Regulatory est une application de gestion réglementaire complète et prête à l’emploi qui relève le défi de créer un ensemble unifié de documents de soumission à partir d’un contenu souvent créé à plusieurs endroits et par différentes équipes, parfois situées dans plusieurs pays.
Assurer la conformité à la FDA grâce à un logiciel de gestion des informations réglementaires
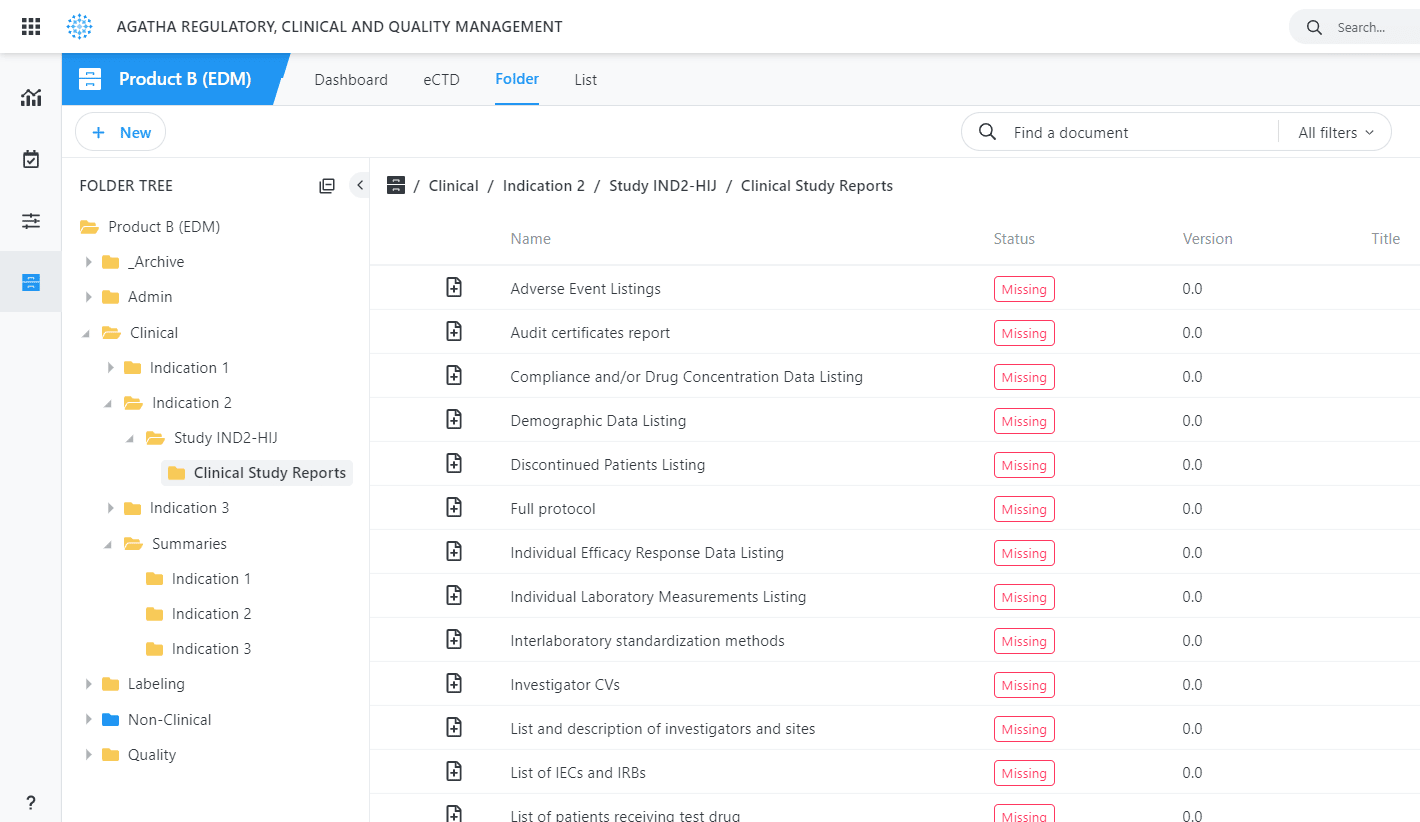
Utilisez l’application pour collecter, organiser et gérer les documents réglementaires de tous les sites d’essais cliniques dans vos classeurs réglementaires avant la soumission, en fournissant une source unique et en faisant autorité pour tout le contenu requis.
Assurez l’approbation réglementaire avec la solution eRegulatory d’Agatha

« Avec Agatha Regulatory, c’est dorénavant possible de créer un CTD qui garantit l’authenticité, la lisibilité et la conservation des documents en accordance avec les directives ER/ES. »
Kiyuki Tanifuji
Group manager Development Planning Group, Clinical Development, Nihon Medi-Physics Co., Ltd.
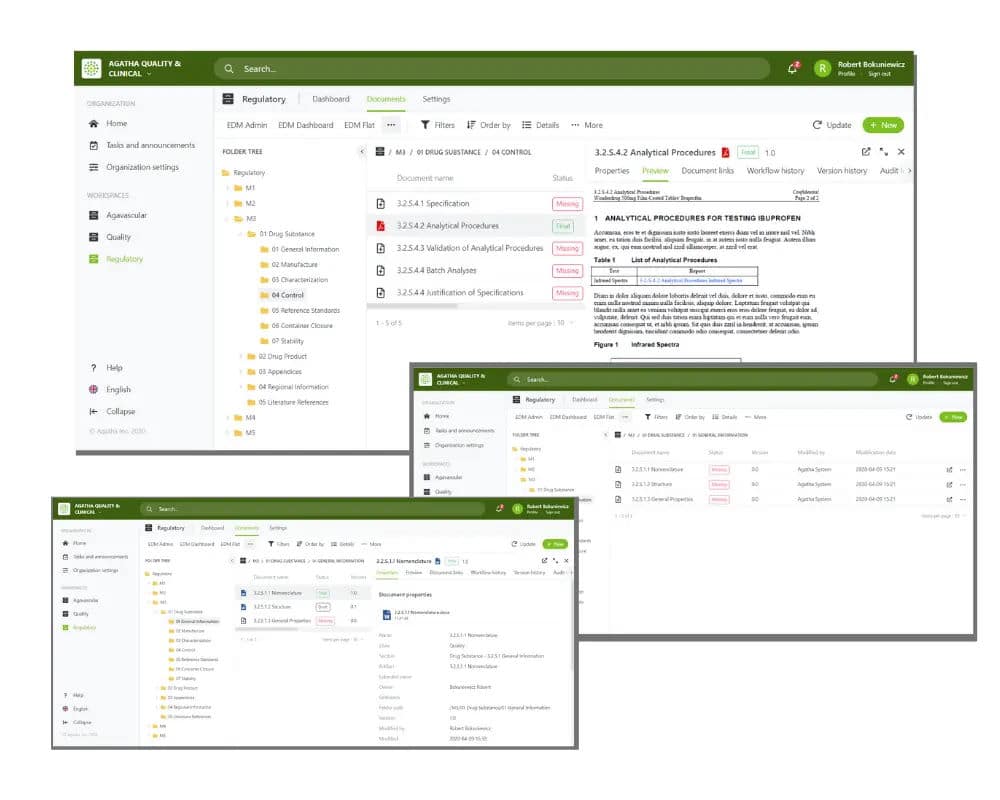
Comment le système de gestion des informations réglementaires d’Agatha accélère le processus de soumission.
Visualiser les soumissions
Parcourez les archives des soumissions dans l’application à l’aide de la visionneuse de soumissions.
Intégration eCTD
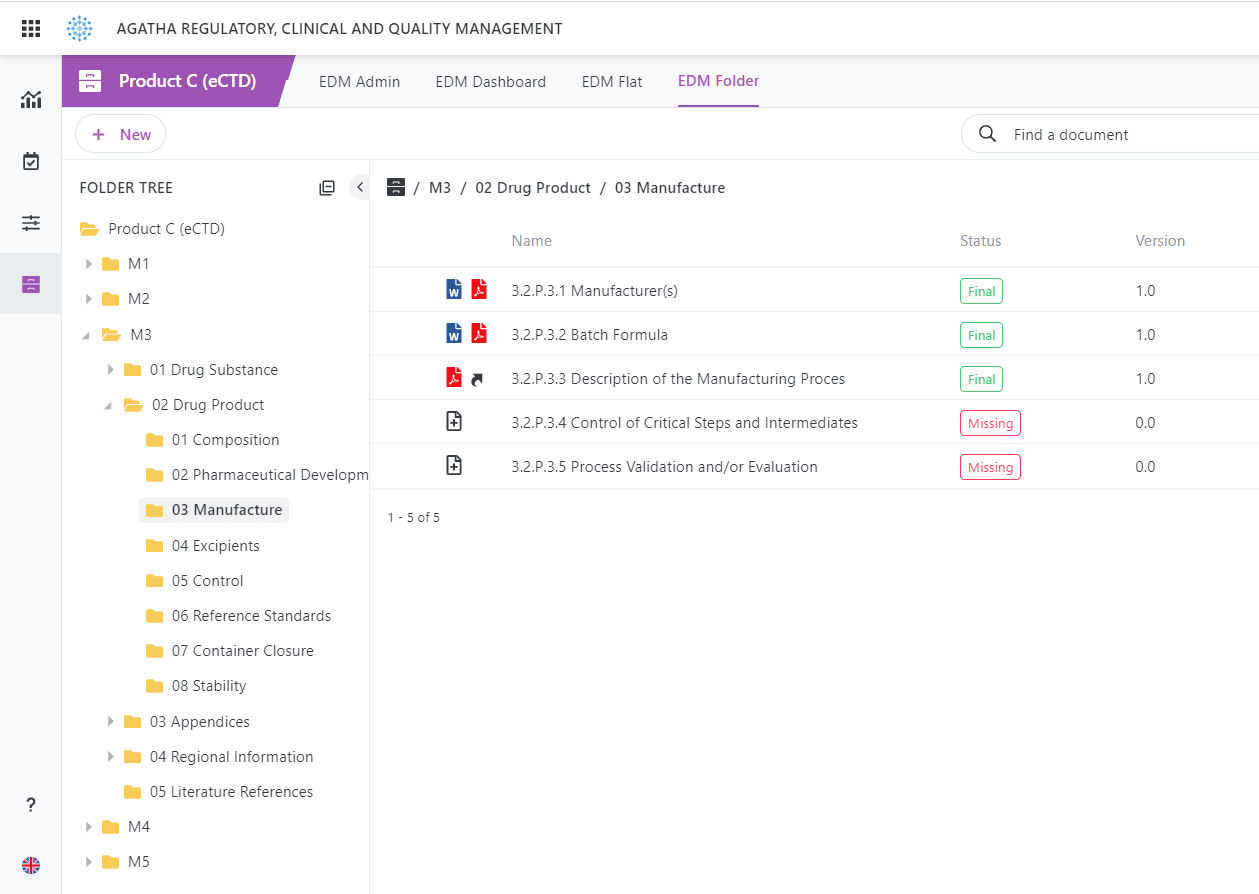
Intégration prête à l’emploi avec la plupart des logiciels de soumission eCTD.
Suivi des demandes
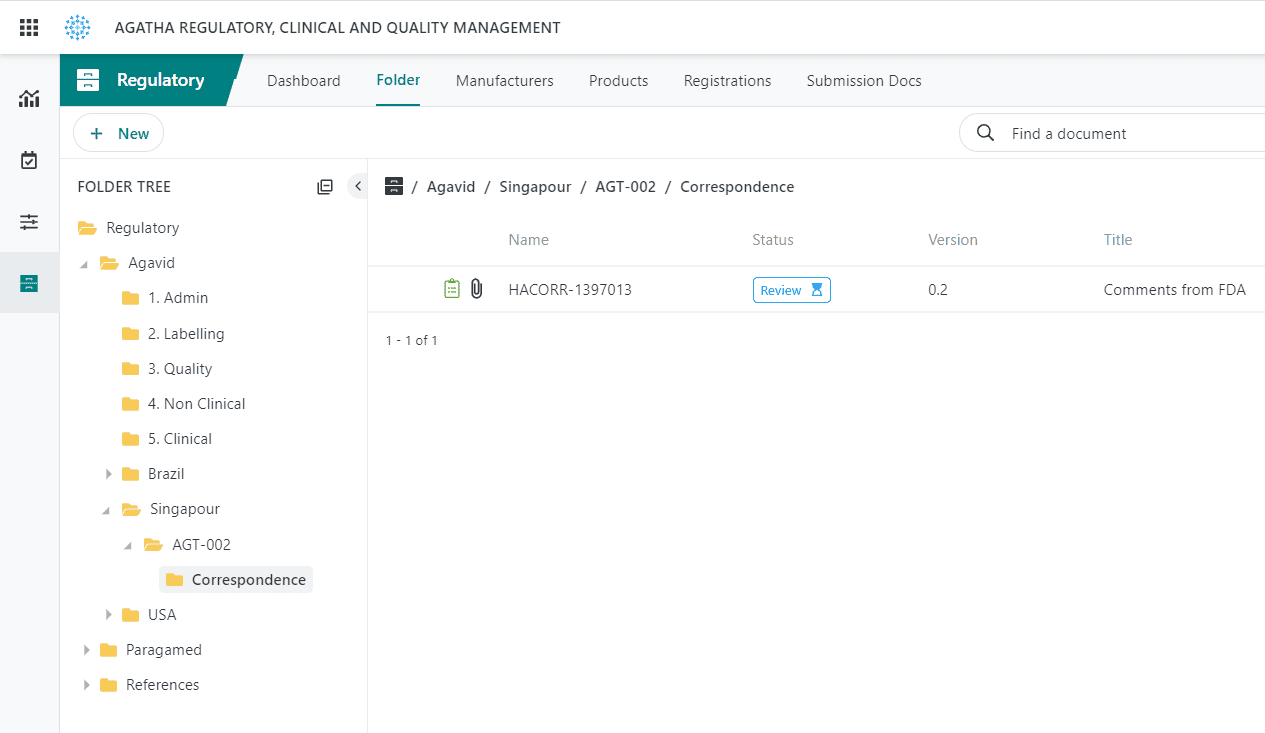
Suivez les demandes réglementaires et la correspondance des autorités sanitaires.
La meilleure façon de savoir si une application Agatha répond à vos besoins est de l’essayer. Et bonne nouvelle – nous proposons un essai gratuit de notre solution eRegulatory pour vos essais cliniques.
Quelques caractéristiques supplémentaires d’eRegulatory
Basé sur des normes
Agatha Regulatory est basé sur le modèle de référence standard de la GED.
Annotations
Examen en ligne simultané des documents avec annotations partagées.
Ce qui manque
Identifiez automatiquement les éléments de soumission manquants à tout moment du processus.
En savoir plus sur la conformité réglementaire et le système de gestion des informations réglementaires d’Agatha
Qu'est-ce qu'un logiciel de gestion de l'information réglementaire ?
Un système de gestion de l’information réglementaire (système RIM) est un logiciel qui aide les entreprises à accélérer leurs processus de conformité réglementaire et à assurer la conformité aux diverses autorités réglementaires. En termes généraux, cette catégorie de système de gestion de l’information aide les entreprises pharmaceutiques à gérer leurs soumissions aux autorités réglementaires.
Les solutions eRegulatory telles qu’Agatha Regulatory offrent une plateforme centralisée permettant aux entreprises de gérer divers documents réglementaires et de préparer des documents de soumission standardisés dans des formats réglementés.
L’importance de la conformité réglementaire dans l’industrie pharmaceutique
Les changements réglementaires ont entraîné un nombre croissant d’exigences imposées aux entreprises opérant dans l’industrie pharmaceutique. Ces exigences peuvent aller de la simple documentation à des processus complexes dont la mise en œuvre nécessite des ressources importantes. En plus de ces exigences, les entreprises doivent s’assurer qu’elles restent conformes à toute modification future de la législation existante.
Quels sont les défis réglementaires auxquels sont confrontées les entreprises pharmaceutiques ?
Les grandes et les petites entreprises sont souvent confrontées à des défis similaires dans leurs flux de travail réglementaires. Beaucoup ressentent ces problèmes de processus réglementaires de manière aiguë à un certain point d’inflexion – une gamme de produits en augmentation, une date limite de soumission ou une expansion géographique. Deux défis communs auxquels sont confrontées les entreprises pharmaceutiques au cours du processus de développement sont l’évolution des exigences réglementaires et les volumes élevés de documentation.
Évolution des exigences réglementaires de la FDA
Dans une entreprise de développement pharmaceutique, la documentation réglementaire ne peut plus être considérée comme une tâche discrète. Rester conforme aux exigences réglementaires changeantes tout au long des essais cliniques oblige les entreprises à s’adapter en permanence à la prolifération des ressources d’information, à la qualité variable et à l’hétérogénéité des informations. De nombreux départements et équipes doivent avoir accès aux documents réglementaires, et les coûts de non-conformité sont importants pour les entreprises pharmaceutiques et les utilisateurs potentiels. Il manque une vision holistique de la documentation réglementaire tout au long du processus de développement.
Le volume de la documentation nécessaire pour rester conforme
Le volume considérable de documents à remplir pour se conformer à la réglementation est un défi pour les entreprises pharmaceutiques. Comme de nombreuses entreprises gèrent des milliers de documents et de formulaires, même des modifications mineures de la documentation, des étiquettes, des analyses statistiques, etc. créent des vagues dans tout le système, provoquent la confusion et prennent du temps. En outre, comme de nombreux départements et groupes différents utilisent la documentation réglementaire, il est nécessaire d’assurer une normalisation et une efficacité à l’échelle de l’entreprise.
Quels sont les avantages offerts par un système RIM ?
Un système de gestion de l’information réglementaire offre une gestion centralisée des données, garantissant que des connaissances réglementaires précises et opportunes sont facilement disponibles et appliquées de manière cohérente dans toute l’organisation. Les processus automatisés éliminent les étapes manuelles, ce qui permet aux équipes de gagner du temps et de se concentrer sur des tâches de plus grande valeur. La visibilité sur l’activité réglementaire permet aux équipes des sites d’essais cliniques de mieux comprendre comment les délais réglementaires s’alignent sur les objectifs commerciaux.
L’efficience et l’efficacité réglementaires se traduisent par une diminution des risques pour les entreprises en matière de non-conformité ou de retrait de produits du marché. Une conformité réglementaire mondiale plus solide et plus sûre signifie qu’elles peuvent mieux gérer leurs opérations à l’échelle mondiale. Un développement plus rapide des produits leur permet de mettre plus rapidement de nouveaux produits sur le marché.
Que doivent rechercher les entreprises pharmaceutiques dans un logiciel d'eRegulatory ?
La technologie eRegulatory existe pour réduire le temps de mise sur le marché de nouveaux produits pharmaceutiques ou dispositifs médicaux. Dans le but de gagner du temps et d’augmenter la collaboration et l’efficacité, les solutions eRegulatory comme Agatha Regulatory permettent aux entreprises des sciences de la vie de réduire les coûts associés à la non-conformité avant, pendant et après la recherche clinique.
Afin de rester conformes aux exigences réglementaires et de gagner du temps, les entreprises du secteur des sciences de la vie devraient rechercher une solution de réglementation en ligne offrant les fonctionnalités suivantes
- Pistes d’audit ;
- Contrôle de version ;
- Formation ;
- Contrôles de sécurité ;
- Capacités de signature électronique ;
- Conventions de dénomination et de classement standard ;
- Prise en charge de la surveillance à distance ;
Tâches réalisées par Agatha Regulatory
L’application eRegulatory d’Agatha :
- Identifie les produits requis pour les agences réglementaires internationales ;
- Collecte les documents techniques tels que les documents techniques communs électroniques (eCTD) ;
- Contrôle l’accès aux documents lorsqu’il s’agit de différents produits et agences réglementaires ;
- Gère les changements et les révisions des documents et des produits ;
- Génère des documents de soumission conformes ;
- Permet la signature électronique des documents d’étude ;
- Délivre et suit les soumissions sur le papier et à travers les passerelles appropriées ;
- Minimise les efforts et le temps de calendrier des entreprises pour reproduire les soumissions réglementaires entre les produits et les autorités réglementaires ;
- S’assure que le contenu original est soumis à temps et correctement ;
- Satisfaire aux exigences réglementaires relatives aux équipements électroniques, telles que 21 CFR Part 11 ;
Quelle est la différence entre réglementation et conformité ?
Bien qu’elles soient étroitement liées, il est important de considérer les différences entre la réglementation et la conformité.
Réglementation par des organismes de réglementation tels que la FDA
La réglementation est un ensemble de règles et de normes imposées par un organisme de réglementation tel que la FDA, généralement dans le but de protéger les personnes ou la planète de tout risque ou dommage potentiel.
Pour garantir la sécurité d’utilisation de leurs produits par les consommateurs, les entreprises de l’industrie pharmaceutique et médicale doivent se conformer aux règlements énoncés dans la législation 21 CFR Part 11 de la Food and Drug Administration (FDA). Cela permet à l’entreprise de maintenir la qualité de ses produits tout au long de leur cycle de vie et de s’assurer qu’ils peuvent être utilisés en toute sécurité par les consommateurs.
Conformité
La conformité réglementaire est un processus continu suivi par les entreprises pharmaceutiques pour répondre aux exigences des organismes de réglementation de leur marché. Être conforme n’est pas binaire. Au contraire, les processus et activités spécifiques entrepris par le personnel sont soit conformes, soit non conformes. La plupart des organisations des sciences de la vie sont également régies par de multiples régimes réglementaires, allant de ceux qui concernent la fabrication des produits à ceux qui portent sur la santé et la sécurité au travail. Par conséquent, une organisation des sciences de la vie peut être en conformité avec un ensemble de réglementations mais non avec un autre.