QMS clinique – Choisissez Agatha Quality comme votre système de management qualité
Agathalife propose une solution de gestion de la qualité pour les professionnels de la santé et les entreprises du secteur des sciences de la vie, avec des fonctionnalités avancées pour la gestion des tiers, des audits et des réclamations, ainsi que l’intégration de la qualité dans l’ensemble de l’activité de l’entreprise. Les clients bénéficient d’une qualité stricte, d’un niveau de qualité produit élevé et d’une gestion électronique efficace, le tout à un prix compétitif.
Gestion avancée de la qualité avec le QMS clinique d’Agatha
Notre entreprise est reconnue pour son expertise dans les sciences de la vie, et sa solution répond aux exigences strictes des GMP et des GCP pour les entreprises pharmaceutiques, biotechnologiques et les fabricants de dispositifs médicaux, tout en garantissant la conformité aux normes de qualité ISO.
Enfin un QMS pour les entreprises des sciences de la vie
Parfaire la qualité c’est, entre autres, minimiser les déviations et non-conformités en fabrication, accélérer le cycle de développement d’un dispositif médical, accélérer les essais cliniques et en améliorer les résultats. À l’inverse, les erreurs liées à la qualité sont invariablement à l’origine d’augmentations importantes des coûts et peuvent grandement perturber les opérations.
Gérer efficacement la conformité et les processus qualité est crucial pour toute entreprise œuvrant dans les sciences de la vie.
Choisir la bonne application pour la gestion des processus qualité au sein de votre entreprise est donc une décision déterminante. Il est maintenant temps de jeter un coup d’œil à l’application Agatha Quality.
Facilitez vous la tâche à l’aide de notre QMS conçu spécifiquement pour votre industrie!
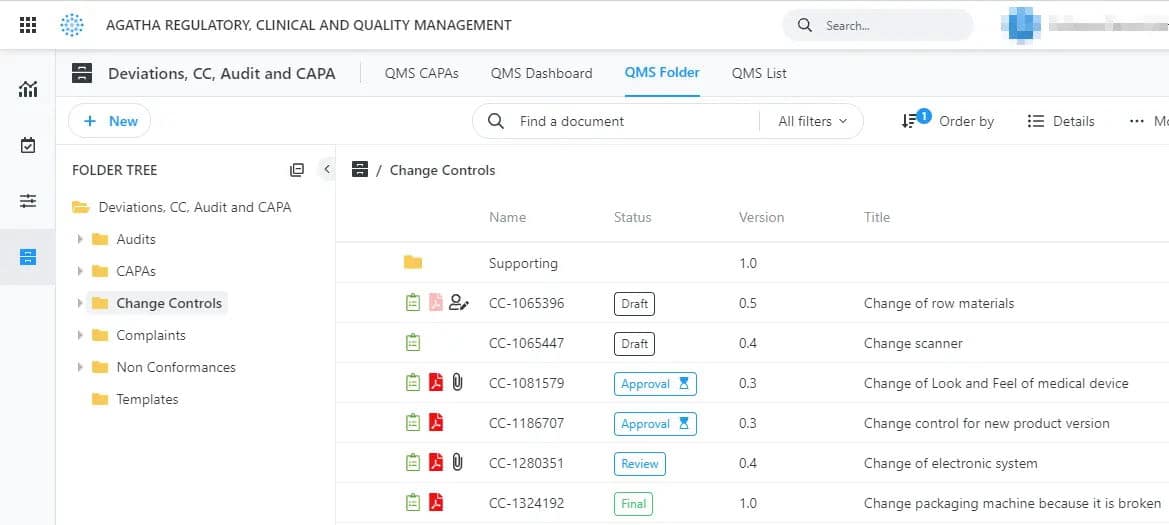
Agatha Quality (QMS)
Agatha Quality (QMS) est une application de gestion de la qualité complète prête à l’emploi, qui permet la saisie des déviations, la documentation des actions correctives et préventives (CAPA) et de gérer les processus de contrôle de changement au cours d’un projet de recherche clinique. La plupart des fournisseurs proposent des formulaires génériques de gestion de la qualité, mais Agatha se concentre sur les principaux formulaires nécessaires aux environnements ClinOps et GMP des entreprises des sciences de la vie.
Système de surveillance et de qualité basé sur les risques
Plus qu’un simple gestionnaire de documents, le QMS est un système de gestion pour l’ensemble des étapes de processus qualité. Combinant des formulaires, des documents et des flux de travail, Agatha Quality constitue un ensemble complet d’outils pour les gestionnaires de la qualité. Préconfigurée, validée et prête à l’emploi, notre application est facile à adapter aux exigences de processus spécifiques.

« La conformité aux obligations qualité est la clef de voûte d’un essai clinique valide et éthique. Les deux objectifs de la qualité — l’intégrité des données et les perspectives d’évolution — peuvent être atteints grâce à une approche systématique de la procédure complète d’un essai clinique. »
Arun Bhatt
Quality of Clinical Trials : A Moving Target, Perspect Clin Res. 2011 Oct-Dec; 2(4): 124-128
Comment Agatha Quality soutient la conformité
Formulaires avancés
Travaillez avec des processus de qualité standard et des formulaires prêts à l’emploi ou adaptez-les à vos besoins spécifiques dans l’application de gestion de processus de qualité. Les formulaires sont dotés de champs de texte enrichis qui vous permettent d’ajouter des images et du texte formaté pour vous assurer des données de qualité. Vous pouvez également utiliser le concepteur de formulaires pour personnaliser l’apparence et le cadre de vos formulaires.
Les formulaires dynamiques à plusieurs étapes pour la gestion des événements qualité et des incidents sont conçus pour guider les clients à travers chaque étape, de la déviation au contrôle des modifications, en ajoutant des sections au fur et à mesure en fonction des informations fournies. Les révisions, les approbations et les affectations d’actions sont intégrées pour garantir des processus de qualité et de contrôle qualité dans votre secteur d’activité.
Métriques et rapports complets
Obtenez tous les rapports dont vous avez besoin grâce aux tableaux de bord et rapports intégrés, générez des rapports personnalisés et exportez n’importe quel rapport vers Excel ou un format CSV générique.
Rapports inter-espace de travail : Vous pouvez également créer des vues et des rapports à travers les espaces de travail et exporter les résultats vers Excel pour les rapports de tableaux de bord.
Enregistrements complets
Obtenez des enregistrements qualité complets avec signatures et pistes d’audit, prêts pour l’inspection. Le système de gestion de la qualité d’Agatha est entièrement conforme à la norme 21 CFR Part 11 et aux exigences réglementaires de l’UE.
L’application de gestion de la qualité d’Agatha est également entièrement intégrée aux autres applications Agatha, ce qui facilite la création de références entre elles (par exemple, une CAPA peut faire référence à une SOP).
Plus qu’un simple enregistrement en ligne
Les formulaires QMS d’Agatha peuvent être convertis en PDF à tout moment, ce qui permet d’obtenir un enregistrement électronique signé au format approprié.
La meilleure façon de savoir si une application Agatha répond à vos besoins est de l’essayer. Bonne nouvelle: nous proposons un essai gratuit d’Agatha Quality!
Vous obtenez plus avec Agatha Qualité
Prévisualisation et annotations de base
Prévisualisez et annotez des documents PDF et Office, ainsi que des images dans le formulaire de rapport d’Agatha Quality.
Rapports inter-espaces de travail
Créez des vues et des rapports à travers les espaces de travail et exportez les résultats vers Excel pour créer des tableaux de bord.
Un processus de bout en bout
Un processus complet, en boucle fermée, capturé dans un formulaire en expansion, du problème initial jusqu’à l’action préventive.
Prêt pour l’inspection
Créez des dossiers de qualité complets avec des signatures électroniques, des approbations enregistrées et des pistes d’audit, le tout prêt pour l’inspection.
Conformité totale
Un système validé conforme aux exigences GxP, aux réglementations européennes et à la norme FDA 21 CFR Part 11.
En savoir plus sur le QMS clinique d’Agatha et les systèmes de gestion de la qualité clinique
Qu'est-ce qu'un QMS clinique?
Un système de gestion de la qualité clinique (QMS) est une application utilisée dans le secteur des soins de santé pour assurer la qualité pendant la recherche clinique menée par les entreprises pharmaceutiques, les fabricants de dispositifs médicaux et les établissements de soins de santé. La recherche clinique nécessite un QMS, car il est important de garantir que tous les processus, les protocoles, les documents et les procédures qui se produisent tout au long d’une étude clinique sont gérés efficacement et font l’objet d’un audit de qualité.
Les avantages offerts par un système de gestion de la qualité clinique
Avec l’utilisation d’un système de gestion de la qualité clinique, les organisations pourront mettre en œuvre les normes réglementaires applicables et les méthodologies nécessaires pour atteindre les objectifs de la recherche clinique. Les applications QMS comme Agatha Quality jouent un rôle crucial dans le maintien de la conformité de la recherche clinique avec les normes réglementaires des organismes internationaux de réglementation tels que les bonnes pratiques cliniques (BPC), l’Agence européenne des médicaments (EMA) et la Food and Drug Administration (FDA) des États-Unis, entre autres.
En outre, la gestion des documents, des incidents, des plaintes, des tiers, des audits et la qualité des informations fournies aux clients sont des aspects importants de la gestion de la qualité clinique. Les applications QMS peuvent aider les entreprises à maintenir un niveau élevé de qualité de leurs produits et services, tout en intégrant la qualité dans leur stratégie globale. Les systèmes de gestion ISO et le contrôle de qualité sont également des éléments clés pour améliorer la qualité et la conformité de la recherche clinique.
Quels sont les avantages d'un QMS?
Amélioration de la sécurité des patients et des consommateurs
Un QMS clinique génère des données fiables qu’une organisation, ses partenaires, les autorités de réglementation et de santé et d’autres parties prenantes peuvent utiliser pour surveiller et améliorer les produits cliniques et la vie des patients. L’utilisation d’un QMS tel que celui d’Agatha Quality donne aux participants aux essais cliniques et aux utilisateurs finaux des résultats de la recherche clinique l’assurance que les médicaments/traitements qu’ils reçoivent ont été développés à partir de recherches appropriées.
Garantie de conformité réglementaire tout au long du processus de recherche
La gestion de la qualité par une application centrale garantit la conformité réglementaire tout au long du processus d’essai clinique. Cette atténuation des risques comprendra les premières études sur les humains jusqu’à la surveillance post-marketing des nouveaux produits pharmaceutiques.
Amélioration de la gestion de la qualité de la recherche clinique
Le bon QMS permet de réduire ou éliminer les problèmes de qualité répétitifs au cours des études cliniques, tels que la non-conformité involontaire, la formation insuffisante du personnel, la supervision insuffisante par la direction, le manque de clarté du protocole et le contrôle insuffisant de la qualité dans la collecte et l’enregistrement des données menaçant la sécurité des patients/l’intégrité des données.
Le QMS d’Agatha offre une structure organisationnelle solide pour aider les entreprises pharmaceutiques à améliorer systématiquement la performance globale de leur recherche clinique, à atteindre leurs objectifs en matière de contrôle de la qualité et de formation et à mener à bien les essais cliniques de manière efficace.
Approche proactive de l’assurance qualité
Une approche réactive n’est pas suffisante pour un système de gestion de la qualité (QMS): de bonnes pratiques de gestion des risques sont essentielles. Gérer de manière proactive la qualité clinique à l’aide d’un QMS bien conçu, au lieu de réagir aux problèmes liés aux produits expérimentaux lorsqu’ils surviennent, permet d’éviter de perdre un temps et des ressources précieux.
Quelles sont les exigences réglementaires pour le développement de médicaments et les études cliniques?
Les principales exigences réglementaires pour tout projet de recherche clinique ou d’investigation clinique mené par une organisation sont les suivantes :
Bonnes pratiques cliniques (BPC)
“Les bonnes pratiques cliniques (BPC) sont une norme internationale de qualité éthique et scientifique pour la conception, la réalisation, l’enregistrement et le compte rendu d’essais impliquant la participation de sujets humains. La conformité à cette norme donne l’assurance publique que les droits, la sécurité et le bien-être des sujets de l’essai sont protégés, conformément aux principes qui trouvent leur origine dans la Déclaration d’Helsinki, et que les données de l’essai clinique sont crédibles.
L’objectif de cette ligne directrice sur les BPC de l’ICH est de fournir une norme unifiée pour l’Union européenne (UE), le Japon et les États-Unis afin de faciliter l’acceptation mutuelle des données cliniques par les autorités réglementaires de ces juridictions.
La ligne directrice a été élaborée en tenant compte des bonnes pratiques cliniques actuelles de l’Union européenne, du Japon et des États-Unis, ainsi que de celles de l’Australie, du Canada, des pays nordiques et de l’Organisation mondiale de la santé (OMS).”
ISO 14155:2020
La norme ISO 14155:2020 ” spécifie les exigences générales destinées à :
- protéger les droits, la sécurité et le bien-être des sujets humains,
- garantir la conduite scientifique de l’investigation clinique et la crédibilité des résultats de l’investigation clinique,
- définir les responsabilités du promoteur et de l’investigateur principal, et
- aider les promoteurs, les investigateurs, les comités d’éthique, les autorités réglementaires et les autres organismes impliqués dans l’évaluation de la conformité des dispositifs médicaux.”
Règlement sur les essais cliniques de l’Agence européenne des médicaments.
Le règlement (UE) n° 536/2014 stipule que :
“Dans un essai clinique, les droits, la sécurité, la dignité et le bien-être des sujets doivent être protégés et les données générées doivent être fiables et solides. Les intérêts des sujets devraient toujours avoir la priorité sur tous les autres intérêts.”
Quels sont les principaux éléments d'un système de gestion de la qualité clinique?
Les principaux éléments d’une stratégie de qualité numérique efficace sont les suivants :
- Les processus ;
- Ressources ;
- Rôles et responsabilités ;
- Partenariat ;
- Gestion des risques ;
- Gestion des problèmes ;
- Gestion des connaissances ;
- Documentation qui soutient la réalisation de la qualité ;