Logiciel pharma QMS – Système de gestion de la qualité pour les entreprises pharmaceutiques par Agatha
Chaque industrie et discipline a des exigences et des cadres de gestion de la qualité uniques. C’est pourquoi un système de gestion de la qualité générique qui n’est pas conçu pour les sociétés pharmaceutiques n’est pas du tout adapté aux exigences (comme les BPF ou les BPC) de l’industrie pharmaceutique.
Choisissez un système de gestion de la qualité conçu pour les entreprises pharmaceutiques.
Agatha Quality aide les organisations pharmaceutiques à garantir la qualité de leurs produits et à atteindre leurs objectifs de qualité, tout en conservant un registre complet de tous les événements et activités liés à leur processus de fabrication. Il fournit une plate-forme unique pour couvrir toutes vos exigences de conformité ; des validations aux pistes d’audit, en passant par les inspections réglementaires et les actions préventives, il peut tout faire.
Améliorer le contrôle qualité et la conformité avec notre QMS pour les entreprises pharmaceutiques
Les entreprises pharmaceutiques doivent privilégier la qualité de leurs produits et services tout en se conformant en permanence aux nouvelles exigences réglementaires. Notre système de gestion de la qualité (QMS) offre une solution complète pour la conformité réglementaire, l’assurance qualité et l’amélioration continue et a été créé spécialement pour l’industrie pharmaceutique.
Demandez un essai gratuit pour découvrir les avantages de notre système de gestion de la qualité pour les entreprises pharmaceutiques.
Essayer notre application QMS est le meilleur moyen de voir si elle répond à vos besoins. Nous fournissons un essai gratuit d’Agatha Quality afin que les sociétés pharmaceutiques puissent examiner toutes ses caractéristiques et fonctionnalités.
Gestion intégrée de la qualité pour les organisations de santé
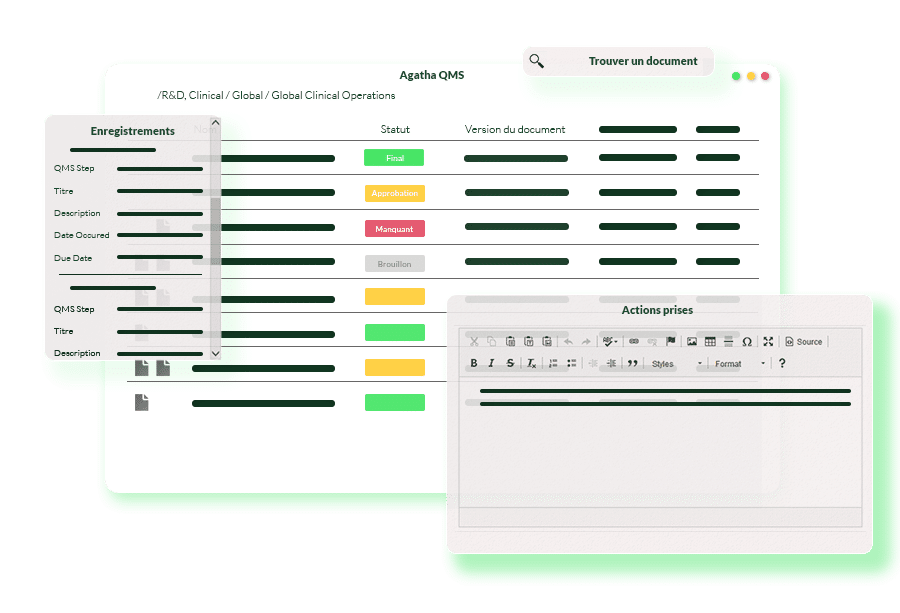
Pour s’assurer que les sociétés pharmaceutiques respectent les exigences réglementaires de l’industrie, notre système de gestion de la qualité a mis en place une variété de procédures et de pratiques, telles que la gestion des audits et des inspections. Le système de gestion des documents facilite la gestion des politiques et procédures qualité, le suivi des non-conformités et des plaintes, et la préservation précise de toutes les activités et décisions liées à la gestion de la qualité. Ceci est essentiel pour présenter la preuve de bonnes pratiques de gestion.
Obtenir des informations solides pour promouvoir l'amélioration continue
Notre système de gestion de la qualité offre des outils perspicaces pour l’amélioration continue, tels que l’analyse des données et la planification des actions correctives, pour identifier les problèmes et apporter des ajustements qui peuvent stimuler la productivité et augmenter le calibre de nos produits et services au fil du temps.
Adaptable et convivial pour répondre aux besoins de l'entreprise
Parce que nous sommes conscients que chaque entreprise pharmaceutique est différente, notre QMS peut être personnalisé pour satisfaire toutes les demandes. Notre équipe d’experts est prête à offrir une formation et une assistance selon les besoins, et la plateforme est simple à utiliser et à naviguer.
Ne laissez pas les problèmes de contrôle qualité et de conformité réglementaire de l’industrie des sciences de la vie entraver le développement de votre entreprise pharmaceutique. Utilisez notre système de gestion de la qualité pour garantir la qualité de vos produits et dispositifs médicaux, respecter les réglementations et aller au-delà des attentes des clients. Notre système est destiné à améliorer les opérations et les procédures de qualité, à soutenir l’assurance qualité dans toute votre organisation et à aider à atteindre les buts et objectifs de qualité.
Plus qu’un enregistrement en ligne
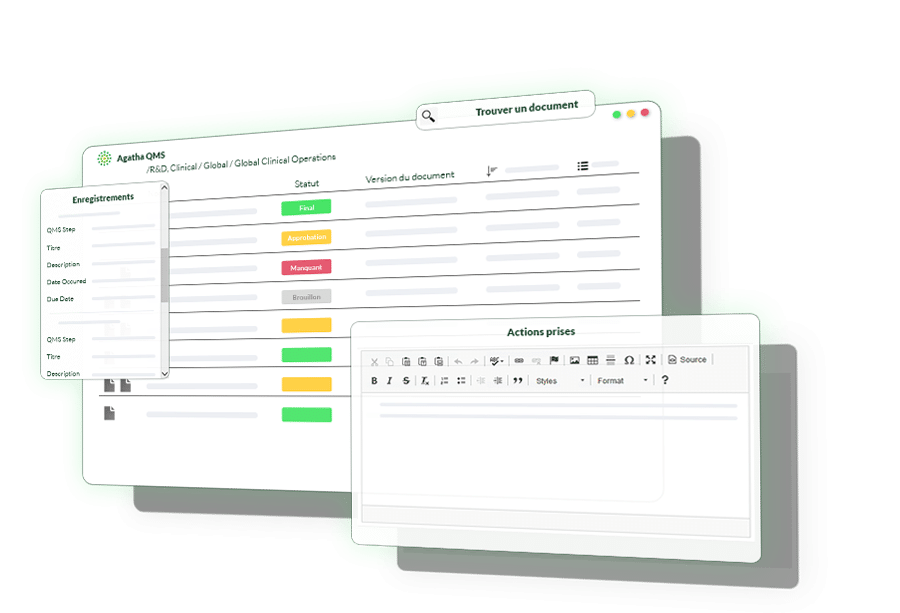
Les formulaires QMS dans Agatha peuvent être convertis en PDF à tout moment, ce qui donne un enregistrement électronique signé au format approprié.
Tirez le meilleur de votre entreprise pharmaceutique avec Agatha Quality
Aperçu et annotation simplifiés des documents
Prévisualisez et annotez des fichiers PDF, des documents Office et des images dans le formulaire de rapport d’Agatha Quality pour un processus de gestion de la qualité efficace et efficace.
Capacités d’intégration avancées
Tirez parti de l’API Rest d’Agatha pour permettre une intégration transparente avec d’autres applications, avec une documentation complète et un exemple de code fourni.
Fonctionnalité de création de rapports inter-espaces de travail
Générez des rapports et des vues dans les espaces de travail et exportez les résultats vers Excel pour faciliter la création de rapports sur le tableau de bord.
Un processus qualité efficace de bout en bout
Profitez d’un processus de qualité complet en boucle fermée qui capture chaque étape du processus, du problème initial à l’action préventive.
Registres prêts pour l’inspection
Conservez des enregistrements de qualité électroniques complets avec des signatures, des approbations et des pistes d’audit prêtes pour les inspections.
Conformité garantie
Soyez assuré qu’Agatha Quality est un système validé conforme aux exigences GxP, aux réglementations de l’UE et à la FDA 21 CFR Part 11, garantissant une conformité réglementaire totale pour votre entreprise pharmaceutique.
En savoir plus sur Agatha Quality et notre Pharma QMS
Qu'est-ce qu'un système de gestion de la qualité clinique?
Un système de gestion de la qualité clinique (CQMS) est une application logicielle utilisée pour le suivi de la qualité lors de la recherche clinique par les sociétés pharmaceutiques et l’industrie des sciences de la vie. La recherche clinique nécessite un système de gestion de la qualité, car un système de gestion de la qualité clinique bien conçu aidera à garantir que toutes les procédures, processus, protocoles, documents, etc., qui se produisent tout au long d’une étude clinique sont gérés efficacement et audités pour la qualité.
Comment le QMS d’Agatha peut-il profiter aux entreprises pharmaceutiques?
Avec l’aide d’un système de gestion de la qualité clinique, une organisation opérant dans le segment pharmaceutique de l’industrie de la santé sera en mesure de mettre en œuvre les normes réglementaires applicables, les concepts et les méthodologies nécessaires pour atteindre les objectifs de la recherche clinique.
Les applications QMS telles qu’Agatha Quality jouent également un rôle important dans la conformité de la recherche clinique aux exigences réglementaires des organismes de réglementation internationaux, tels que les bonnes pratiques cliniques (GCP), l’Agence européenne des médicaments (EMA) et la Food and Drug Administration (FDA) des États-Unis. , et d’autres.
Quels sont les avantages d'un QMS clinique?
Amélioration de la sécurité des patients et des consommateurs
Un système de gestion de la qualité clinique génère des données fiables qu’une organisation, ses partenaires, les autorités de réglementation et de santé et d’autres parties prenantes peuvent utiliser pour surveiller et améliorer les produits cliniques et la vie des patients. L’utilisation d’un système de gestion de la qualité clinique tel qu’Agatha Quality donne aux participants aux essais cliniques et aux utilisateurs finaux des résultats de la recherche clinique l’assurance que les médicaments/traitements qu’ils reçoivent ont été développés à l’aide d’une recherche appropriée.
Conformité réglementaire garantie tout au long du processus de recherche
La gestion de la qualité via une application centrale garantit la conformité réglementaire tout au long du processus d’essai clinique. Cette atténuation des risques comprendra des premières études chez l’homme pour la surveillance post-commercialisation de nouveaux produits pharmaceutiques.
Amélioration de la gestion de la qualité de la recherche clinique
Réduire ou éliminer les problèmes de qualité répétitifs au cours des études cliniques tels que la non-conformité involontaire, la formation insuffisante du personnel, la supervision insuffisante par la direction, le manque de clarté du protocole et le contrôle de qualité insuffisant dans la collecte et l’enregistrement des données menaçant la sécurité des patients/l’intégrité des données.
Le système de gestion de la qualité clinique Agatha Quality offre une structure organisationnelle solide pour aider les entreprises pharmaceutiques à améliorer systématiquement la performance globale de leur recherche clinique, à atteindre leurs objectifs de contrôle qualité et de formation et à mener à bien les essais cliniques de manière efficace.
Approche proactive de l’assurance qualité
Une approche réactive ne suffit pas pour un logiciel de gestion de la qualité (CQMS): de bonnes pratiques de gestion des risques sont essentielles. La gestion proactive de la qualité clinique avec un CQMS bien conçu au lieu de réagir aux problèmes liés aux produits expérimentaux lorsqu’ils surviennent évite de perdre un temps et des ressources précieux.
Quelles sont les exigences réglementaires pour le développement de médicaments et les études cliniques?
Les principales exigences réglementaires pour tout projet de recherche clinique ou d’investigation clinique mené par un organisme sont:
Bonnes pratiques cliniques (BPC)
« Les bonnes pratiques cliniques (BPC) sont une norme internationale de qualité éthique et scientifique pour la conception, la conduite, l’enregistrement et la notification d’essais impliquant la participation de sujets humains. Le respect de cette norme fournit l’assurance publique que les droits, la sécurité et le bien-être des sujets de l’essai sont protégés, conformément aux principes qui trouvent leur origine dans la Déclaration d’Helsinki, et que les données de l’essai clinique sont crédibles.
L’objectif de cette directive ICH GCP est de fournir une norme unifiée pour l’Union européenne (UE), le Japon et les États-Unis afin de faciliter l’acceptation mutuelle des données cliniques par les autorités réglementaires de ces juridictions.
La ligne directrice a été élaborée en tenant compte des bonnes pratiques cliniques actuelles de l’Union européenne, du Japon et des États-Unis, ainsi que de celles de l’Australie, du Canada, des pays nordiques et de l’Organisation mondiale de la santé (OMS).
ISO 14155:2020
L’ISO 14155:2020 « spécifie des exigences générales destinées à:
- protéger les droits, la sécurité et le bien-être des sujets humains,
- s’assurer de la conduite scientifique de l’investigation clinique et de la crédibilité des résultats de l’investigation clinique,
- définir les responsabilités du promoteur et de l’investigateur principal, et
- assister les promoteurs, les investigateurs, les comités d’éthique, les autorités réglementaires et les autres organismes impliqués dans l’évaluation de la conformité des dispositifs médicaux.
Réglementation des essais cliniques de l’Agence européenne des médicaments
Le règlement (UE) n° 536/2014 stipule que:
“ Dans un essai clinique, les droits, la sécurité, la dignité et le bien-être des sujets doivent être protégés et les données générées doivent être fiables et solides. Les intérêts des sujets doivent toujours primer sur tous les autres intérêts.”
Quels sont les principaux éléments d'un QMS clinique?
Les éléments clés d’une stratégie de qualité numérique efficace impliquent les éléments suivants:
- processus ;
- Ressources;
- Rôles et responsabilités;
- partenariat ;
- Gestion des risques;
- Gestion des problèmes;
- Gestion des connaissances;
- Documentation qui soutient l’atteinte de la qualité ;