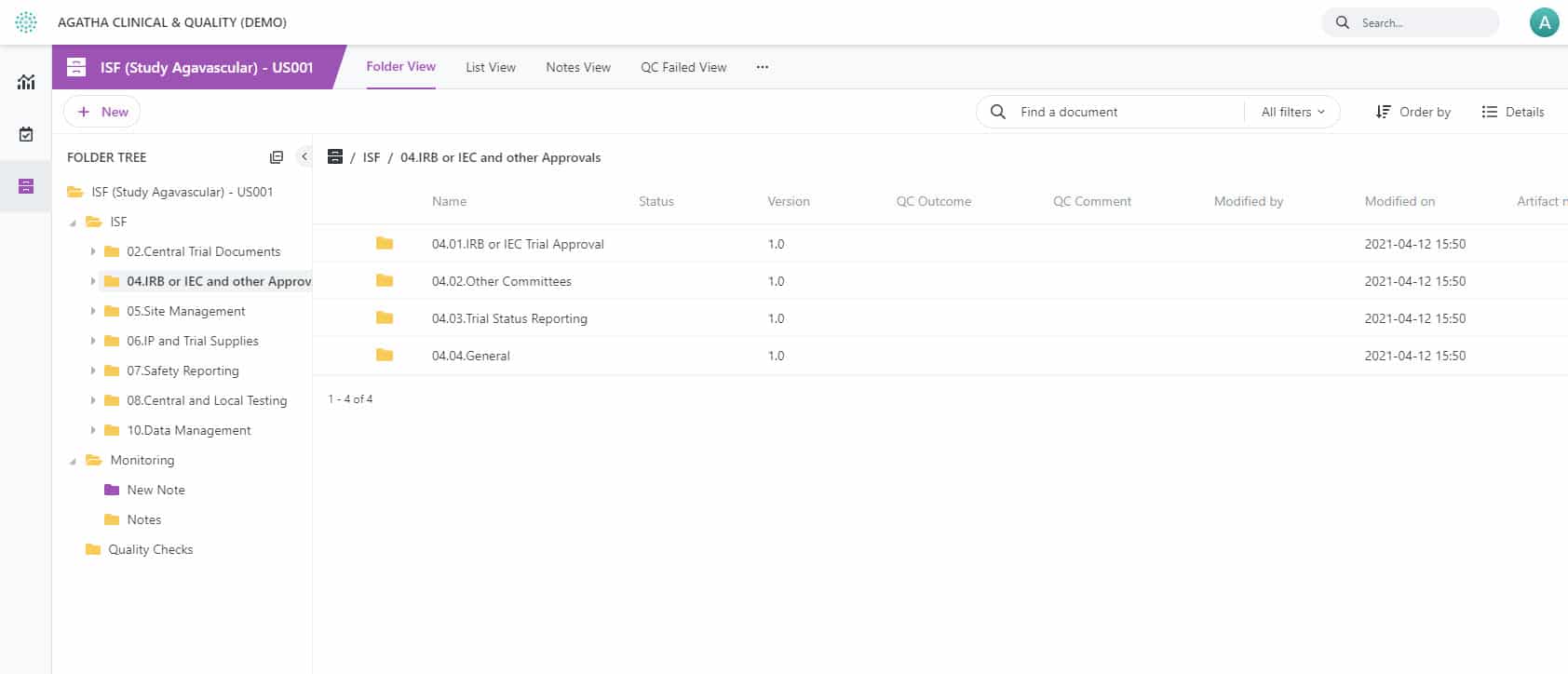
Agatha Remote ISF – Surveillez vos sites d’essais cliniques avec un eISF
Choisissez un eISF pour la surveillance des sites à distance
Réduisez le besoin d’une supervision en présentiel grâce à un dossier électronique du site d’investigation. Simplifiez la surveillance à distance et la gestion de la qualité pour les sites cliniques avec la solution eISF d’Agatha pour essais cliniques.
La surveillance à distance des sites lors d’essais cliniques améliore la qualité et réduit les coûts
Si vous consacrez beaucoup de temps et d’argent à la surveillance de vos sites cliniques et que vous cherchez un meilleur moyen de le faire, Agatha Remote Monitoring est ce qu’il vous faut.
Standardiser vos différents sites de recherche clinique en supprimant les classeurs papier
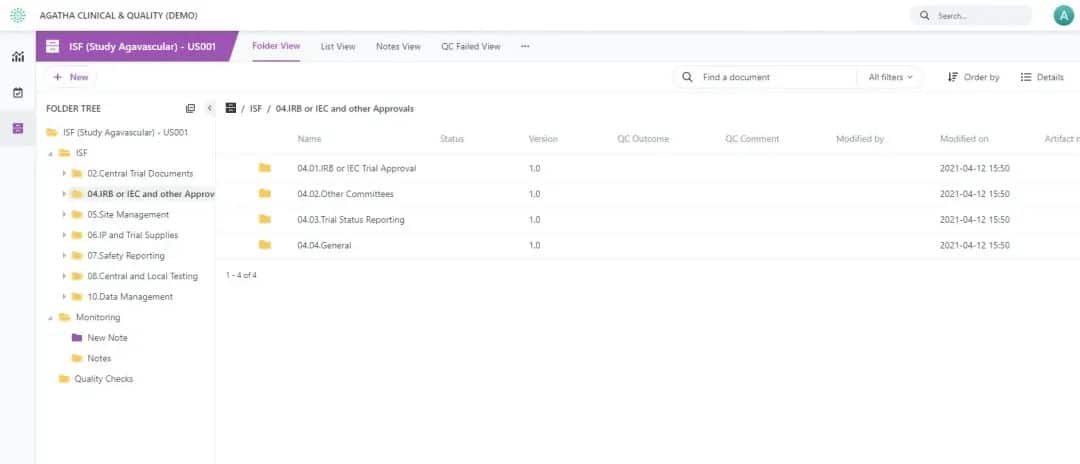
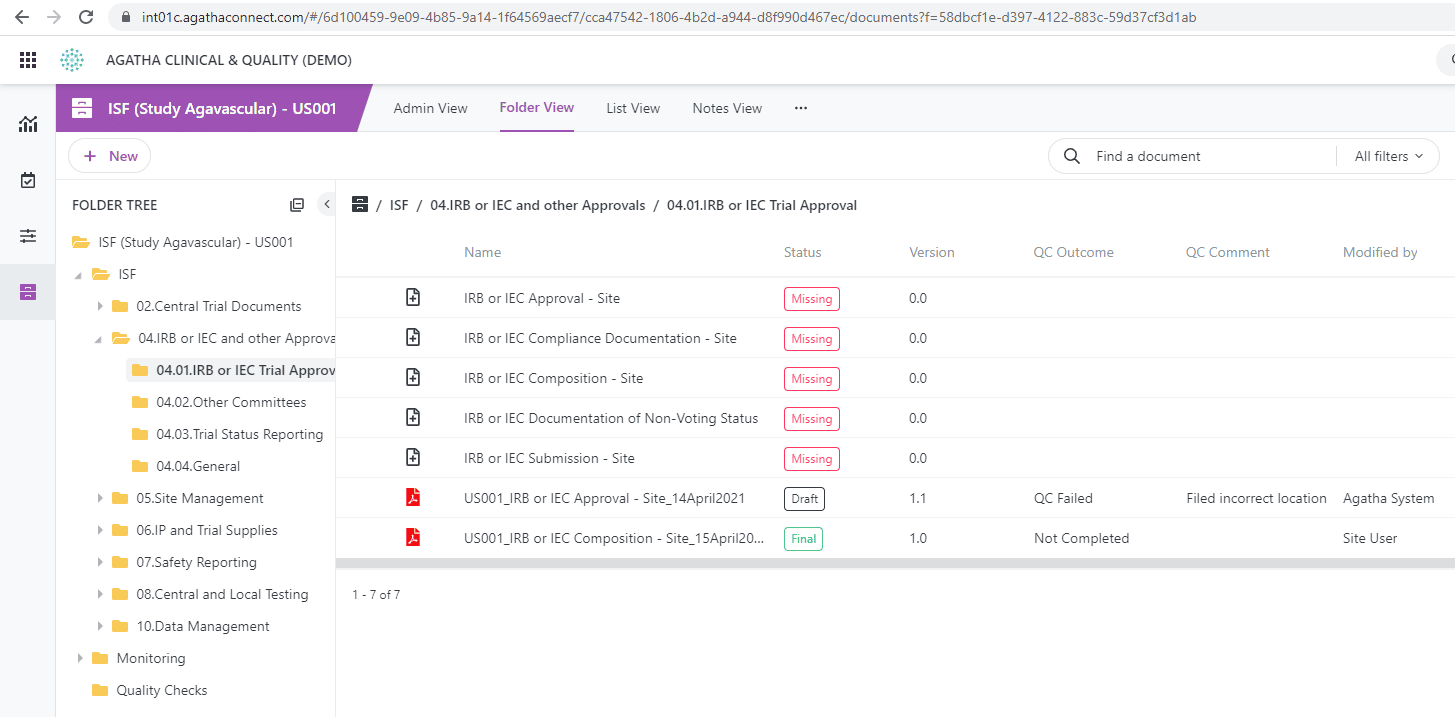
Simplifiez votre processus d’essai clinique et gardez votre documentation d’étude clinique prête pour un audit avec la solution eISF d’Agatha pour essais cliniques. Rendez tous vos documents d’étude essentiels disponibles à distance et identifiez les documents manquants beaucoup plus facilement qu’en examinant les classeurs physiques de chaque site d’essai.
Connectez les moniteurs et les sites grâce à la surveillance à distance
Agatha Remote Monitoring permet aux moniteurs et aux inspecteurs d’examiner les fichiers sources, de prendre des notes et d’accomplir leurs tâches de surveillance de façon efficace. L’application permet également la création et l’attribution de tâches pour les administrateurs de sites, y compris les notifications et le suivi dans une application conforme au 21 CFR Part 11 et à la HIPAA.
Éliminez les visites de surveillance régulières sur les sites d’essais cliniques avec Agatha

« Auparavant, les superviseurs se déplaçaient sur nos sites pour parcourir la documentation dont ils avaient besoin, et pour en tirer des feedbacks. Les coordinateurs de l’étude et les autres membres du site étaient souvent là, donc il y avait des interactions et des retours qu’on a rarement sur un framework à distance. Nous voulions être sûrs que nos superviseurs pouvaient toujours faire leur travail correctement, même en distanciel. »
Guilia Bignami
Clinical Research Associate, Optos
Améliorez les processus de configuration et de documentation de votre site.
Configuration facile des sites et des études
Créez des zones distinctes et sécurisées pour que chaque site puisse gérer sa documentation. Chaque site et chaque étude est livré avec un ensemble complet d’espaces réservés aux documents attendus.
Accéder aux espaces de travail et aux tâches depuis votre tableau de bord
Affichez les espaces de travail de chaque site d’essai clinique dans le tableau de bord pour visualisez et accédez rapidement aux tâches qui vous sont assignées. Utilisez les vues configurables pour inspecter, vérifier et identifier à tout moment les lacunes du contrat eTMF.
Partagez le contenu des classeurs en temps réel
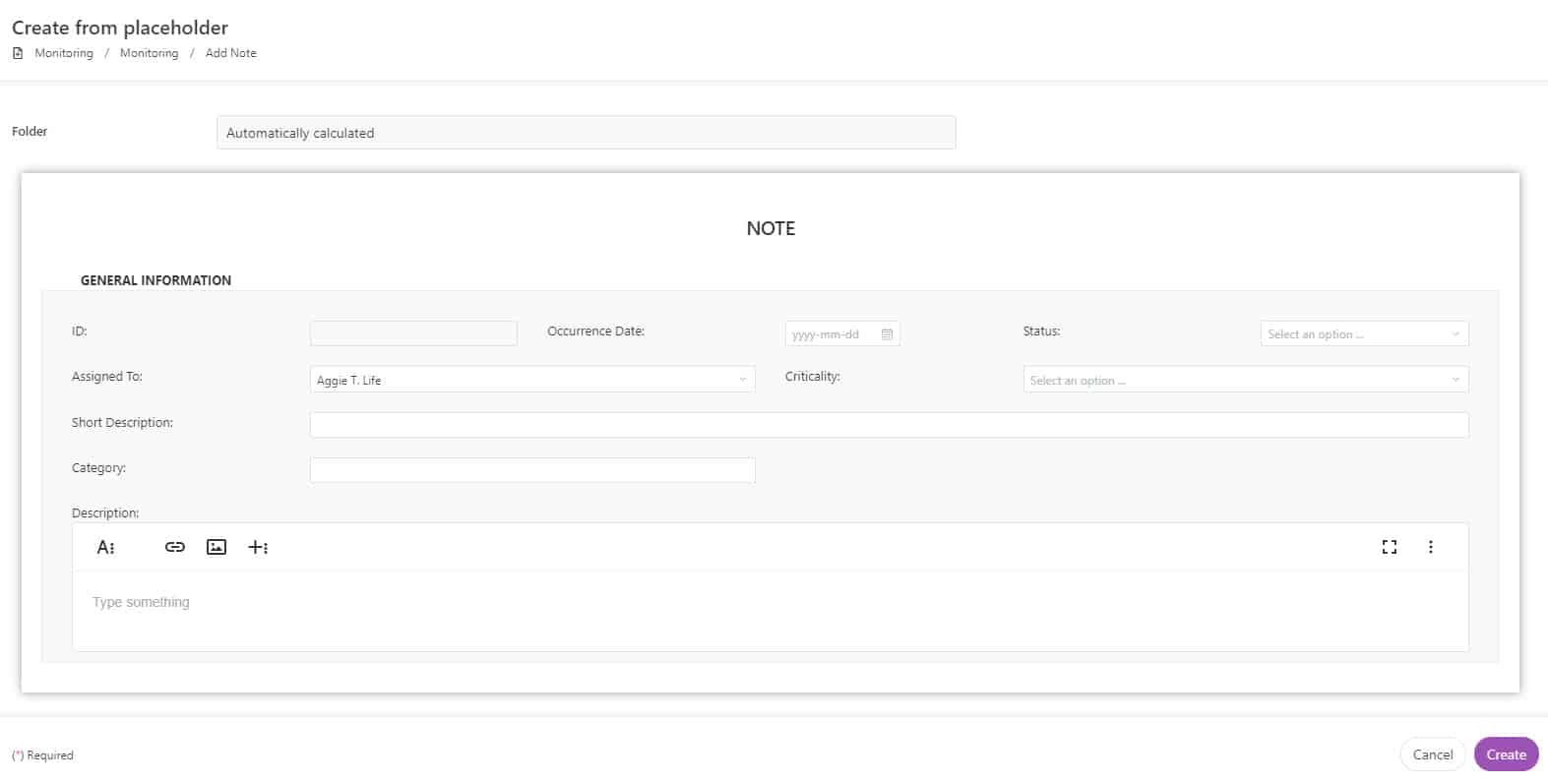
Partagez le contenu des classeurs ISF entre les moniteurs, les sites et les sponsors pour permettre la révision des documents à distance et le contrôle de la qualité. Utilisez les formulaires pour partager les notes des moniteurs et assigner des tâches au personnel du site.
Gérer le contrôle de la qualité et automatiser la conformité
Désignez des documents pour le processus de contrôle qualité et suivez l’examen de la qualité à l’aide de vues personnalisées. Accélérez les flux de travail (workflows) avec les signatures électroniques pour répondre à toutes les exigences de conformité et configurez des flux de travail automatisés pour déplacer les documents finaux de l’étude clinique vers le TMF principal.
La meilleure façon de savoir si une application Agatha répond à vos besoins est de l’essayer. Et bonne nouvelle – nous offrons un essai gratuit de notre eISF pour vos essais cliniques!
L’eISF d’Agatha ne s’arrête pas là
Formulaires et rendus personnalisés
Formulaires personnalisés pour piloter des processus basés sur des métadonnées et pour générer des rendus.
Prévisualisation et annotations de base des documents essentiels du site
Prévisualisez et annotez des documents PDF et Office, ainsi que des images.
Rapports inter-espace de travail
Créez des vues et des rapports à travers les espaces de travail et exportez facilement les résultats vers Excel.
Jeux de modèles étendus
Recueillez les commentaires des sites avec les enquêtes post-marché et les documents de consentement.
Gestion avancée des politiques et des accès
Gérez facilement les politiques, les rôles associés et le contrôle d’accès.
Boîte à outils d’intégration avancée
Utilisez l’API Rest d’Agatha pour permettre aux applications de télécharger ou d’exporter des éléments depuis Agatha (documentation et exemple de code inclus).
En savoir plus sur la surveillance des sites à distance et sur la solution Agatha de dossier électronique d’enquêteur.
Qu'est-ce qu'un eISF?
Pourquoi utiliser un eISF ?
Les sites d’essais cliniques fonctionnent souvent sans protocole normalisé en ce qui concerne l’ISF, et il s’agit encore souvent d’une documentation sur papier. Cela peut causer des difficultés, surtout si l’on considère que les sponsors peuvent appliquer des structures de rapports différentes. Par conséquent, l’ISF est souvent différent pour chaque site d’étude et la collaboration est rendue difficile en raison du support papier. Agatha Remote Monitoring offre une solution et un modèle de référence pour améliorer l’ISF pendant les essais cliniques.Proposez des modèles standardisées d’ISF à vos sites d’essais.
Quels documents sont conservés dans l’ISF?
Exemples de documents conservés dans un eISF
L’eISF doit comprendre tous les documents pertinents à l’étude, soit les documents de formation, les informations sur le financement, la documentation sur la sécurité, les documents de surveillance, etc. Les documents à rendre disponible pour l’audit dans l’eISF sont les suivants:- Le protocole de l’essai;
- Fiche d’information du participant et formulaires de consentement;
- Brochure de l’investigateur;
- Documents réglementaires, demandes et approbations;
- Journaux de délégation;
- Rapports de sécurité;
- Correspondance entre le personnel du site délégué et le sponsor;
- Dossier pharmaceutique;
Combien de temps les documents eISF sont-ils conservés après une étude clinique ?
Après la fin des essais cliniques et la clôture d’une étude clinique, les documents essentiels doivent être conservés conformément aux exigences réglementaires. La norme de l’industrie est de conserver les documents eISF pendant 30 ans afin que les contrôleurs ou les régulateurs puissent y accéder si nécessaire.
Quelle est la différence entre un eTMF et un eISF ?
L’ISF est un sous-ensemble de documents stockés dans le dossier principal eTMF. La différence entre l’eTMF et l’eISF est que l’ISF est compilé individuellement par chaque site d’essai. Le sponsor de la recherche peut alors rassembler les fichiers ISF de chaque site d’essai et les compiler dans l’eTMF.
Les systèmes ETMF et le modèle de référence TMF ont été adoptés par l’ensemble du secteur, mais il n’existe pas de modèle ISF spécifique pour les sites : ils ne disposent pas de structures de classement précises et normalisées. La suppression des dossiers ISF papier et la gestion électronique des documents ISF essentiels d’un site garantissent une structure standard dans tous les sites d’étude.