Logiciel SOP Agatha – Gestion des documents SOP et de la formation
Logiciel de gestion des SOP pour la recherche clinique
Une solution prête à l’emploi pour la création, l’approbation, la gestion et la publication de procédures opératoires normalisées et le suivi des activités de formation des employés.

Assurez la conformité grâce à une application de gestion des SOP de vos essais cliniques
Les politiques standard sont au cœur de chaque opération qualité.
Les procédures opérationnelles standard (SOP) et les documents de formation des employés sont essentiels à l’efficacité des opérations et à la conformité aux exigences réglementaires lors de la recherche clinique. La gestion de ces deux éléments dans une seule et même application facilite grandement la tâche. C’est là que l’application Agatha SOP peut vous aider.
Gagnez un temps précieux avec l’application cloud Agatha SOP.
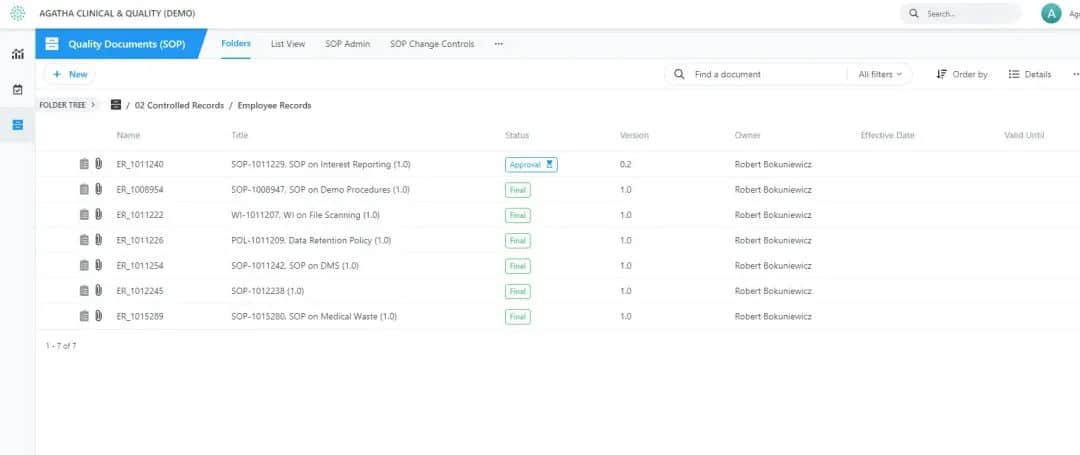
Gérez les procédures opérationnelles standard et les dossiers des employés
Agatha SOP est une application basée sur le cloud qui vous permet de suivre la conformité de vos employés aux procédures opérationnelles normalisées et leur formation. Elle est fournie avec un ensemble standard de modèles ainsi que des processus d’examen et d’approbation standard. Vous pouvez ensuite configurer l’application à partir du modèle standard pour répondre à vos besoins, en fonction de vos essais cliniques.
Standardisez vos opérations cliniques avec un logiciel de gestion des SOP cliniques
L’application SOP d’Agatha fournit des enregistrements d’audit, des modifications documentées et des signatures électroniques pour garantir que chaque activité est entièrement documentée, conforme aux directives réglementaires et prête à être inspectée.

Clients dont la recherche clinique a bénéficié de notre solution de procédures opératoires standard
« Avec les capacités d’analyse, je peux récupérer des indicateurs comme les formations par département pour une SOP particulière. Ainsi, je peux obtenir un graphique pour la SOP 001, et voir qui est formé et qui ne l’est pas par département et par personne. Je peux récupérer ce graphique et l’intégrer à un PowerPoint pour le présenter au management. »
Charles Oviawe
directeur senior Assurance Qualité, BeyondSpring.
Comment les procédures opérationnelles standard d’Agatha soutiennent vos processus.
Commencez par les modèles de procédures opérationnelles standard pour les essais cliniques.
Créez et documentez des politiques complètes à partir d’un ensemble de modèles de procédures opérationnelles standard. Déclenchez automatiquement des révisions périodiques à des intervalles prédéfinis pour garantir des activités de formation actualisées et une documentation complète en fonction de vos études cliniques. Assurez l’exécution des tâches liées aux essais cliniques conformément aux directives institutionnelles, provinciales et fédérales (ou autres directives applicables).
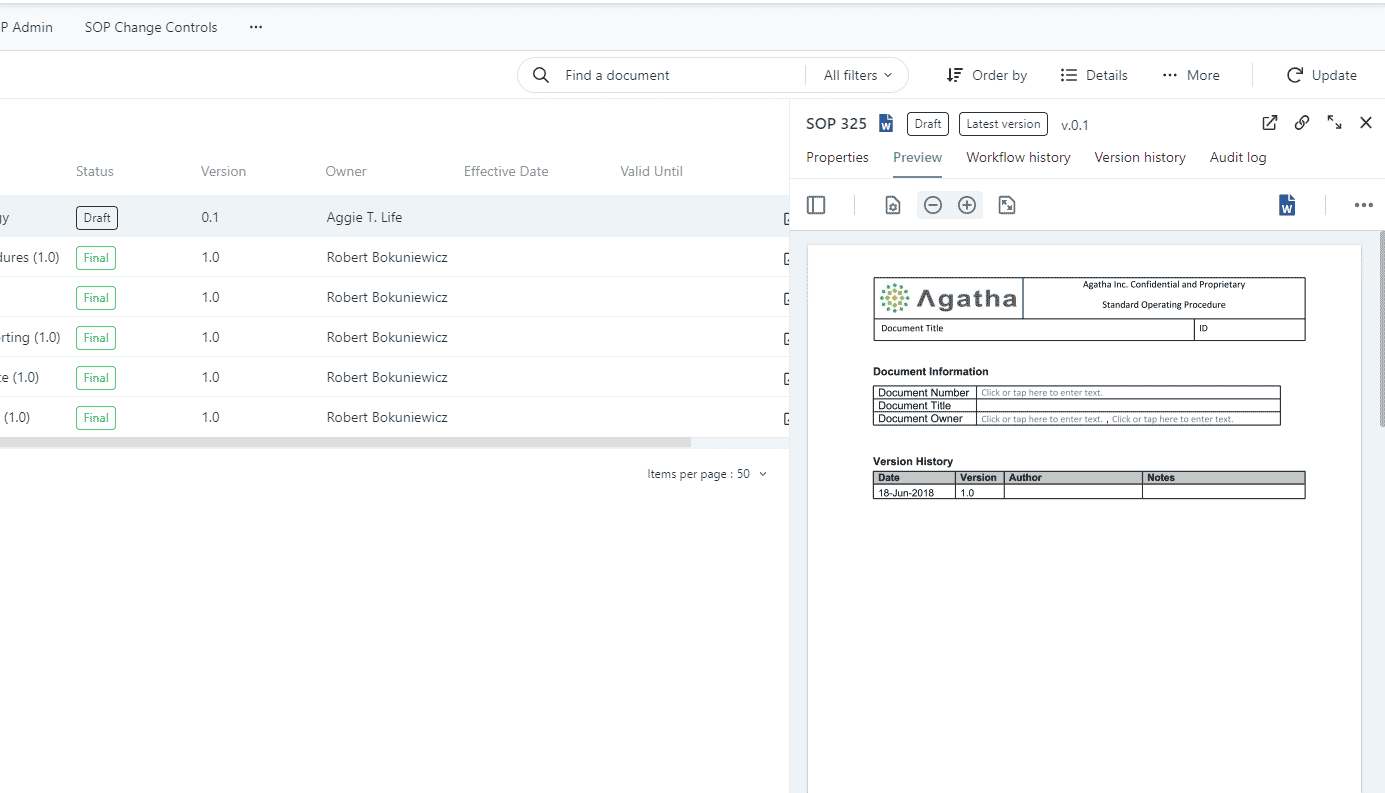
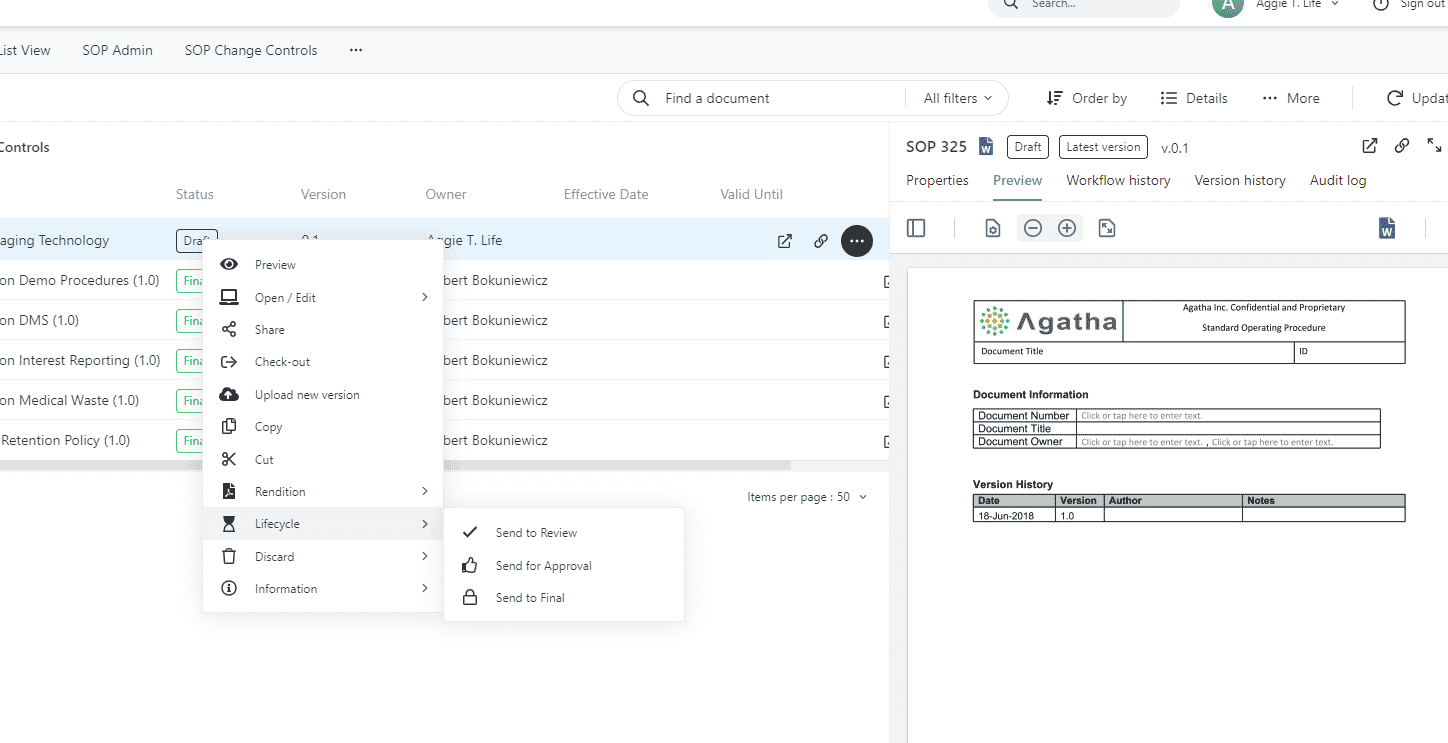
Réviser et approuver les SOPs
Gérez et surveillez les processus de création, de révision et d’approbation des SOP à l’aide de flux de travail prêts à l’emploi et faciles à modifier. Conservez les versions antérieures de toutes les SOP et les pistes d’audit, en documentant tous les changements apportés à chaque SOP en cas d’événements imprévus.
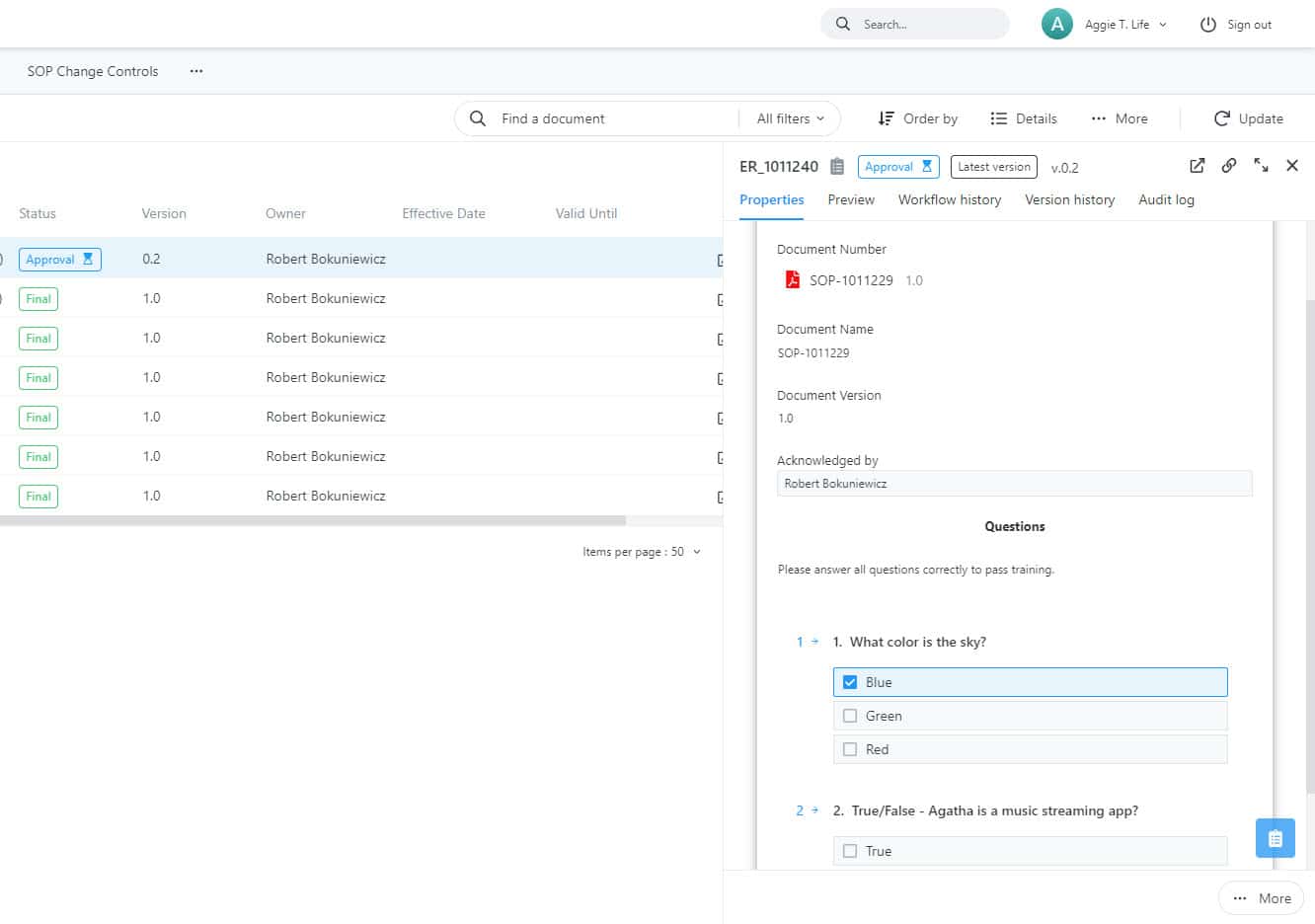
Suivez la conformité de vos employés aux nouvelles procédures opérationnelles standard
Suivez la conformité des employés aux SOP et les activités de formation en utilisant des ressources de formation telles que des documents, des présentations et des vidéos. Exigez la réussite de quiz pour vous assurer que les nouveaux processus sont compris. Assurez-vous que les personnes responsables respectent les procédures opérationnelles standard à intervalles réguliers afin de garantir une formation actualisée.
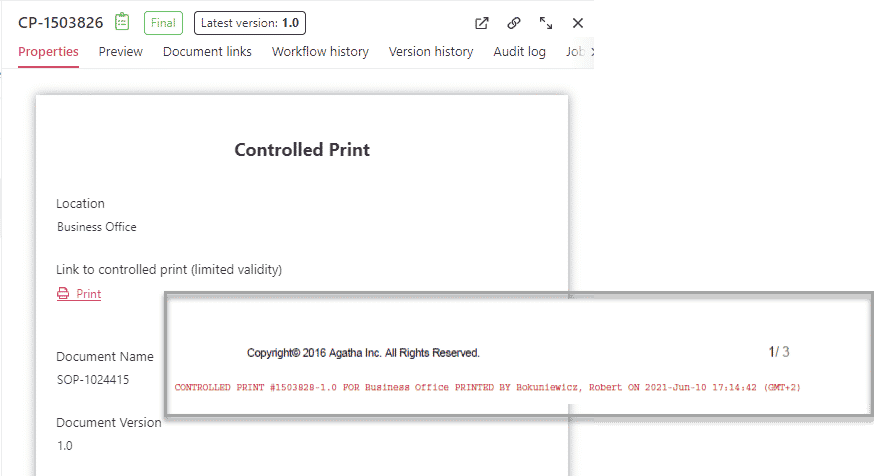
Suivi des copies papier
Assurez-vous que les copies papier sont gérées correctement grâce à l’impression contrôlée.
Vous obtenez plus avec l’application SOP d’Agatha pour les études cliniques
Formulaires et rendus personnalisés
Exploitez les formulaires pour piloter des processus basés sur les métadonnées et utilisez les métadonnées pour générer les rendus. Assurez la cohérence des structures de données (titre de l’unité, en-têtes de sections, taille de police cohérente).
Aperçu et annotations de base
Prévisualisez et annotez des documents PDF et Office, ainsi que des images.
Rapports inter-espaces de travail
Créez des tableaux et des rapports à travers les espaces de travail et exportez les résultats vers Excel pour créer des tableaux de bord.
Cloud sécurisé
Hébergé dans un service de cloud hautement sécurisé et conforme qui répond aux besoins des clients les plus sensibles à la sécurité.
Préparation facile des audits
Simplifiez la préparation des audits grâce à des documents de procédures opératoires normalisées complets, des dossiers de formation précis et des vues et rapports spécialisés pour les inspecteurs.
Boîte à outils d’intégration avancée
Utilisez l’API Rest d’Agatha pour permettre aux applications de télécharger ou d’exporter des éléments depuis Agatha (documentation et exemple de code inclus).
En savoir plus sur les procédures opérationnelles standard et l’application SOP d’Agatha pour les essais cliniques
Que sont les procédures opératoires standard (SOP) ?
Les procédures opérationnelles standard (SOP) sont un ensemble d’étapes et de procédures utilisées par une organisation pour décrire clairement les fonctions quotidiennes nécessaires à son activité. La tenue d’une liste standard à l’aide de logiciels de gestion des SOP aide les entreprises à se conformer aux normes de l’industrie et à la législation fédérale ou provinciale. Dans le domaine de la recherche clinique, les modèles de SOP doivent suivre les directives des Good Clinical Practices (GCP), en particulier dans la recherche sur les sujets humains.
L’importance des SOPs dans les essais cliniques
Les SOPs (Standard Operating Procedures) sont des documents qui décrivent les étapes spécifiques suivies lors de la réalisation d’un essai clinique. Les modèles de SOP d’Agatha pour les essais cliniques sont basés sur diverses normes internationales, notamment les suivantes :
- Food and Drug Administration (FDA) ;
- Office for Human Research Protections (OHRP) ;
- Lignes directrices de la Conférence internationale sur l’harmonisation (CIH) ;
- les exigences de Santé Canada en matière de sécurité alimentaire
- Lignes directrices sur les bonnes pratiques cliniques ;
- Énoncé de politique des trois Conseils sur l’éthique de la recherche sur les sujets humains ;
Les modèles SOP standard pour essais cliniques accélèrent les essais, augmentent les chances de succès de la recherche clinique, améliorent la vitesse de développement et réduisent les niveaux de risque pendant les essais cliniques. Le respect des procédures opérationnelles standard (SOP) peut garantir que ces pratiques sont appliquées de manière cohérente sur tous les sites, assurant ainsi la cohérence dans la conduite des essais cliniques.
Comment former les employés aux modèles SOP d'Agatha pour essais cliniques ?
Une fois qu’une entreprise pharmaceutique a choisi les MON d’essai clinique d’Agatha, le système gère la distribution à tous les employés qui doivent se conformer aux MON. En outre, toute modification apportée à la PON est communiquée à tous les employés afin qu’ils puissent comprendre comment le changement les affecte.
Agatha SOP permet aux administrateurs de suivre la conformité des employés aux SOP et de proposer aux employés des activités de formation aux SOP à l’aide de documents et de vidéos. En exigeant la réussite de quiz pour s’assurer que les nouveaux processus sont compris, les entreprises pharmaceutiques s’assurent que le SOP d’Agatha est bien compris et mis en œuvre dans les essais cliniques.
Quels sont les documents de recherche clinique standardisés à l'aide d'Agatha ?
Agatha propose à ses utilisateurs un ensemble standard de modèles, qui peuvent ensuite être adaptés en fonction des besoins spécifiques d’un essai clinique. Parmi les modèles de SOP d’essais cliniques proposés par Agatha SOP, on peut citer :
- Politiques et procédures de flux clinique ;
- Plan de gestion de la recherche clinique ;
- Consentement ;
- Mise en œuvre du protocole ;
- Documentation source ;
- Documents essentiels ;
- Graphiques de bureau ;
- Visites d’étude et visites manquées ;
- Médicaments de l’étude ;
- Gestion de la toxicité ;
- Recrutement des sujets ;
- Registres et codes des sujets ;
- Remboursement du transport ;
- Liste de contrôle pour la soumission au comité d’éthique ;
- Enquête d’évaluation des nouveaux protocoles ;
- Manuel d’orientation ;
- Plan de gestion de la qualité ;
- Liste de contrôle du coordinateur de recherche ;
- Liste de contrôle de l’infirmière de l’étude ;
- Visites de contrôle ;
- Affaires réglementaires ;
- Signatures ;
- Évaluation du site ;
- Responsabilité du site ;
- Numéros d’identification du patient et de l’étude ;
- Rapports de sécurité ;
- Dossier de formation ;